 Разработка урока химии в 9 классе по теме “Переходные металлы” (“Амфотерность”) по программе О.С. Габриеляна.
Разработка урока химии в 9 классе по теме “Переходные металлы” (“Амфотерность”) по программе О.С. Габриеляна.
Задачи урока:
- создать условия для развития умений учащихся давать характеристику химических элементов на основании положения в ПСХЭ.
- организовать деятельность учащихся по изучению и первичному закреплению понятия «амфотерность».
- содействовать развитию у учащихся исследовательских умений в процессе выполнения и наблюдения эксперимента.
Требования к уровню подготовки учащихся:
объяснять:
- физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И. Менделеева;
- закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп
характеризовать:
- химические элементы на основе их положения в периодической системе Д.И.Менделеева и особенностей строения их атомов;
- химические свойства основных классов неорганических веществ;
составлять:
- формулы неорганических соединений изученных классов;
- схемы строения атомов первых 20 элементов периодической системы Д.И.Менделеева;
- уравнения химических реакций;
обращаться с химической посудой и лабораторным оборудованием.
Оборудование: ПСХЭ, таблица «Зависимость диссоциации гидроксидов от заряда ядра и радиуса центрального атома», штатив с пробирками, универсальный индикатор, оксид хрома(VI), растворы: хлорида хрома(III), сульфата цинка, гидроксида натрия, соляной кислоты.
На столах учащихся: штатив для пробирок, 2 пробирки, растворы: сульфата цинка, гидроксида натрия, соляная кислота.
Ход урока:
1. Организационный момент.
2. Проверка домашнего задания.
3. Актуализация знаний учащихся – фронтальная беседа.
1) На какие группы делят химические элементы по проявляемым свойствам?
2) На какие группы делят химические элементы по электронному строению?
3) Как изменяются металлические свойства атомов химических элементов, расположенных в одной главной группе?
4) Объясните причину усиления металлических свойств атомов химических элементов, расположенных в одной главной группе.
5) Какие окислительно-восстановительные свойства характерны для атомов металлов?
6) Как изменяются металлические свойства атомов химических элементов, расположенных в одном малом периоде?
7) Объясните причину ослабления металлических свойств атомов химических элементов, расположенных в одном малом периоде.
8) Какие окислительно-восстановительные свойства характерны для атомов неметаллов?
4. Постановка целей и задач урока.
Познакомиться с особенностями строения атомов переходных химических элементов, свойствами их оксидов и гидроксидов.
5. Переходные элементы расположены в побочных подгруппах больших периодов периодической системы. Они являются d- и f-элементами. Название «переходные» связано с тем, что в периодах переходные элементы вклиниваются между s- и р-элементами.
IV, V и VI периоды содержат по 10 d-элементов, VI период включает также 14 f-элементов (лантаноиды). В незавершенном VII периоде известно 7 d-элементов, начиная с Ac, и 14 f-элементов (актиноиды). В отличие от s- и p-элементов, у которых заполняется внешний энергетический уровень (соответственно ns- и np-оболочки), у атомов переходных элементов заполняются внутренние (n – 1) d-оболочки (d-элементы) или (n – 2) f-оболочки (f-элементы).
Задание. Дать характеристику цинка на основании его положения в Периодической системе химических элементов.
Для выяснения характера гидроксида цинка и его оксида выполним лабораторную работу. Ознакомьтесь с инструкцией. Какие вещества необходимы для выполнения работы? Ответьте на вопросы, перечисленные в начале инструкции.
ЛАБОРАТОРНАЯ РАБОТА
Получение гидроксида цинка и исследование его свойств.
Рассмотрите схему опытов получения и исследования свойств гидроксида цинка.
Какие действия вам нужно выполнить по ходу лабораторной работы? Какова их цель?
Целесообразно ли выполнять все предложенные опыты?
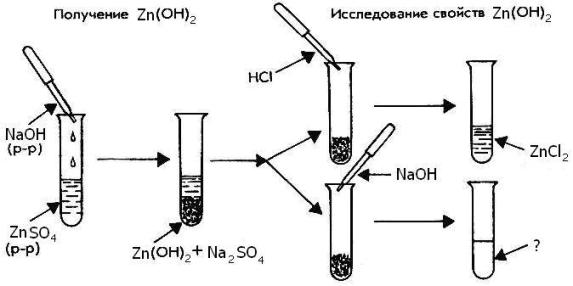
Выполните все предложенные опыты. Запишите сделанные наблюдения, составьте уравнения проведенных реакций в молекулярной и ионной форме.
Сделайте вывод, какими свойствами обладает гидроксид цинка.
Обсуждение результата лабораторной работы.
Гидроксид цинка взаимодействует как с раствором кислоты, так и с раствором щелочи. В чем причина такого необычного поведения гидроксида цинка как нерастворимого основания? Чтобы ответить на этот вопрос вспомним, что взаимодействовать могут гидроксиды, проявляющие противоположные свойства:
основание + кислота = соль + вода.
В реакции с кислотой гидроксид цинка выступает в роли основания:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O.
В реакции с основанием гидроксид цинка проявляет свойства кислоты:
2NaOH + Zn(OH)2 = Na2ZnO2 + 2H2O.
Формулу гидроксида цинка можно записать как основной форме Zn(OH)2, так и в кислотной – H2ZnO2.
Более правильно данную реакцию записать в следующем виде:
2NaOH + Zn(OH)2 = Na2[Zn(OH)4] .
Аналогичными свойствами обладает не только гидроксид цинка, но его оксид:
ZnO + 2HCl = ZnCl2 + H2O.
2NaOH + ZnO + Н2О = Na2[Zn(OH)4] .
Амфотерные соединения – вещества, которые в зависимости от условий проявляют кислотные или основные свойства.
Элементы, образующие амфотерные оксиды и гидроксиды, в Периодической системе химических элементов обозначены зеленым цветом. Как видно из Периодической системы, к этим элементам относят большинство переходных металлов, а также бериллий и алюминий.
Большинство d-металлов не имеют постоянной степени окисления и образуют соответственно несколько оксидов и гидроксидов. Например, хром в соединениях проявляет степени окисления +2, +3, +6.
Задание. Составьте формулы всех оксидов и гидроксидов хрома, заполните таблицу.
|
|
Cr+2 |
Cr+3 |
Cr+6 |
| Формула оксида |
CrO |
Cr2O3 |
CrO3 |
| Формула гидроксида |
Cr(OH)2 |
Cr(OH)3 |
H2CrO4 |
| Характер оксида и гидроксида |
основный |
амфотерный |
кислотный |
Демонстрация. Получение гидроксида хрома(III) и изучение его кислотно-основных свойств.
CrCl3 + 3NaOH = Cr(OH)3 + 3NaCl.
Cr(OH)3 + 3HCl = CrCl3 + 3H2O.
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] + H2O.
Вывод – гидроксид хрома(III) – амфотерный гидроксид.
Демонстрация. Получение хромовой кислоты и изучение ее кислотно-основных свойств.
CrО3 + Н2O = Н2CrO4.
Испытание раствора хромовой кислоты универсальным индикатором.
Вывод – гидроксид хрома(VI) – кислотный гидроксид.
Оксид и гидроксид хрома в низшей степени окисления имеют основные свойства, в вышей – кислотные, а в промежуточной – амфотерные. Эта закономерность справедлива не только для соединений хрома, но и для соединений всех переходных металлов, имеющих разные степени окисления.
Обобщим изменение кислотно-основных свойств атомов химических элементов на примере элементов III периода.
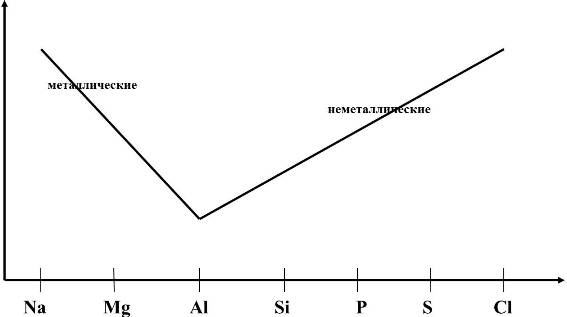
Алюминий стоит на границе между элементами, проявляющими металлические и неметаллические свойства. Он отличается от остальных химических элементов III периода. У него произошло совмещение двух противоположных свойств – металлических и неметаллических. Этот факт отражается на свойствах соединений алюминия, его оксида и гидроксида. Они проявляют амфотерный характер.
Таким образом, изменение кислотно-основных свойств оксидов и гидроксидов химических элементов, расположенных в одном периоде происходит постепенно: от элементов–металлов, через элементы, образующие амфотерные оксиды и гидроксиды к элементам–неметаллам.
10. Закрепление.
Дайте определение понятий:
Переходный элемент
Амфотерные соединения.
Ответьте на вопрос:
От чего зависит химическая роль амфотерного соединения в химической реакции?
.pdf (1 161КБ)











Хорошая статья, честно, мне очень понравилось,
постер вообще постоянно радует читателей своими статьями.
с изложенным материалом с многим сложно не согласится.
от всего сердца продолжайте в том же духе.